Директива 2014/30/ЄС щодо електромагнітної сумісності спрямована на те, щоб все електричне та електронне обладнання не створювало електромагнітних перешкод і не піддавалося їх впливу, що дуже важливо для медичного обладнання, яке підпадає під вимоги Регламенту 2017/745.
Аспекти безпеки, що розглядаються Директивою з ЕМС, є невід'ємною частиною загальних вимог, встановлених у Законі з ЕМС.
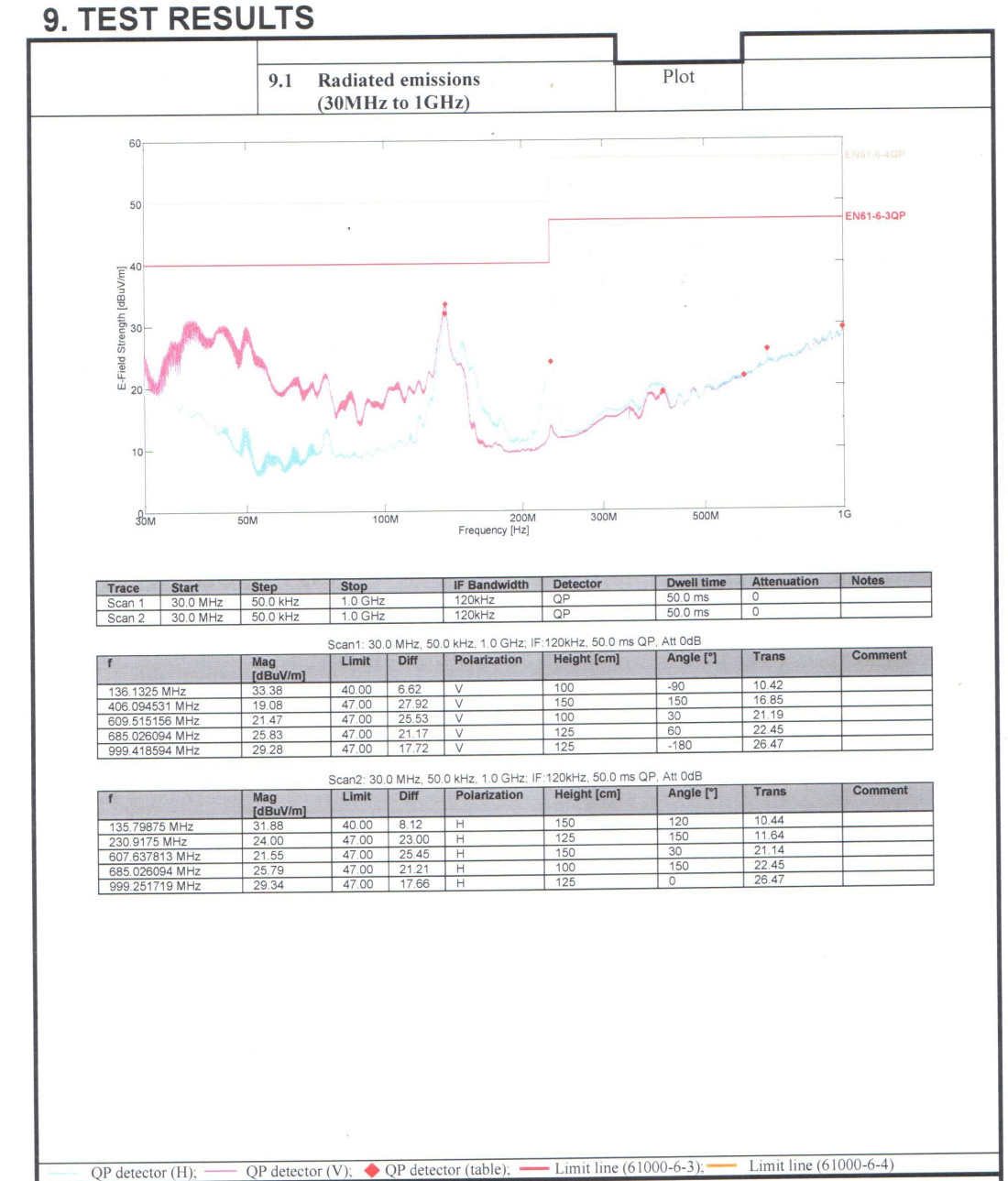
Тестування медичних продуктів за EMC вимагає більш суворого підходу, ніж інші продукти, через тип середовища, в якому вони знаходяться. Електричні та електронні медичні пристрої високого ризику можуть піддаватися впливу перешкод (EMI), які можуть призвести до потенційних збоїв в роботі, викликаючи незручності і навіть небезпечні для життя ситуації.
Регламент 2017/745 є законодавчим актом Співтовариства і медичні вироби повинні відповідати вимогам Директиви 2014/30/EU.
Вироби повинні бути спроектовані і виготовлені з урахуванням сучасних вимог, щоб гарантувати, що:
• генерувані електромагнітні перешкоди не перевищують рівня, вище якого інше обладнання не може працювати належним чином;
• воно має рівень несприйнятливості до перешкод, очікуваних при використанні за призначенням, що дозволяє йому працювати без неприйнятного погіршення характеристик при використанні за призначенням.
Стаціонарні установки повинні бути встановлені з застосуванням передової інженерної практики та з урахуванням інформації про передбачуване застосування.
Директива щодо медичних виробів (MDD 93/42 / EEC) та Регламент щодо медичних виробів (MDR 2017/745) вимагають відповідності «загальновизнаному рівню техніки». У контексті EMC це означає, що пристрій не повинен ставити під загрозу клінічний стан або безпеку пацієнтів, демонструючи відповідність узгодженим стандартам ЄС.
Продукти, які розміщуються на ринку, повинні відповідати EN 60601-1-2: 2015 (IEC 60601-1-2: 2014 + Додаток ZZ (Охоплення основних вимог директив ЄС)).
Виробники, імпортери та уповноважені представники, що мають відношення до вищезазначених пристроїв, повинні перевіряти, чи не втратили чинності звіти про випробування, на яких базується відповідність їх продукції Electromagnetic Compatibility.
Подаючи заявку на випробування, рекомендуємо надати опис усіх пристроїв, пов'язаних з електромагнітною сумісністю, із зазначенням характеристик і середовища передбачуваного використання, зокрема:
· опис пристрою, його функцій і режимів, включаючи структурні схеми, фотографії, кабелі, аксесуари та сумісне обладнання;
· опис джерела живлення (тобто тільки від мережі, тільки від батареї, від мережі і з живленням від акумулятора) і чи можна використовувати медичний пристрій під час зарядки;
· заява про навколишнє середовище, в якому медичний виріб повинен перебувати під час використання, в тому числі середовище професійної установи охорони здоров'я, середовище домашнього застосування, магнітно-резонансне середовище, транспорт / амбулаторія, інше / спеціальне навколишнє середовище;
· опис будь-якої бездротової технології, Директива 2014/53/ЄС);
· опис конкретних радіочастотних випромінювачів у медичному пристрої, які можуть бути джерелами електромагнітних збурень.
Вказівка середовища передбачуваного використання дає важливу інформацію для визначення відповідного тестування на предмет очікуваних електромагнітних перешкод.
Ми рекомендуємо замовникам надати короткий опис ризиків, пов'язаних з несправністю, порушеннями або погіршенням робочих характеристик розглянутого медичного пристрою через перешкоди. Це повинно включати кожну потенційну несправність, порушення або деградацію через перешкоди (EMI), які можуть завдати шкоди пристрою, пацієнту, користувачам або оператору.
Ми рекомендуємо проводити випробування на ЕМС з використанням методів, описаних у визнаних гармонізованих стандартах, які підходять для медичних пристроїв.
Якщо стандарти, зазначені в заявці, не є гармонізованими, має бути надано достатнє обґрунтування того, що дані стандарти адекватно враховують електромагнітну сумісність, ґрунтуючись на функціях, режимах і показаннях медичного пристрою.
Якщо не існує узгодженого європейського стандарту для певного типу медичного пристрою, ми рекомендуємо проводити випробування на електромагнітну сумісність щодо прогнозованих електромагнітних перешкод у середовищі передбачуваного використання серії стандартів EN 61326. Електричне обладнання для вимірювання, управління та лабораторного застосування. Вимоги EMC.
Кожна зміна в специфікації випробувань повинна бути задокументована і супроводжуватися обґрунтуванням.
Конфігурація медичного пристрою та умови передбачуваного використання можуть визначати застосовність узгоджених стандартів для Electromagnetic Compatibility. Їх можна узагальнити в одну або декілька з наступних категорій:
Медичне електричне обладнання EN 60601-1-2 – Загальні вимоги безпеки з урахуванням основних функціональних характеристик. Паралельний стандарт. Вимоги та випробування.
EN 60601-1 Медичне електричне обладнання Частина 1. Загальні вимоги безпеки з урахуванням основних функціональних характеристик
Критерії відповідності / невідповідності продуктивності та несприйнятливості є основоположними для виконання та оцінки і адекватності випробувань на електромагнітну сумісність, що підтверджують безпеку та працездатність медичного виробу.
Тестування проводиться відповідно до стандартів медичного електричного обладнання та Electromagnetic Compatibility.
Маркування повинно відображати ризики для пацієнтів і операторів і включати будь-які заходи щодо їх зниження і необхідні попередження, засновані на результатах випробувань.
Важливо включити в маркування інформацію, що відноситься до ЕМС, тому що тестування може бути недостатньо для зниження ризику, пов'язаного з використанням у всіх середовищах. Специфікації ЕМС в маркуванні можуть допомогти кінцевим користувачам вибрати обладнання з електромагнітною стійкістю, сумісною з навколишнім середовищем, в якому працює пристрій, або для порівняння характеристик ЕМС можливого обладнання до покупки.
Надання інформації про ЕМС на етикетці (наприклад, в інструкції з експлуатації) може допомогти ознайомити користувачів з деградацією, яка може бути викликана електромагнітним випромінюванням, зрозуміти принцип роботи і обставини, яких слід уникати.
Ми рекомендуємо, щоб вся інформація включала інформацію про EMC, щоб забезпечити безпечну та ефективну установку і використання медичного пристрою в передбачуваних електромагнітних середовищах протягом очікуваного терміну служби. Інформація, пов'язана з ЕМС, може бути представлена у вигляді фізичного маркування на медичному пристрої або в супровідних документах, таких як інструкції з експлуатації, посібник користувача та технічні і сервісні посібники.
Інформація про ЕМС, включена в маркування, повинна відповідати специфікаціям узгоджених стандартів медичного обладнання, на які посилаються пристрої, і заявник заявляє про відповідність в EU Declaration of conformity.
Маркування CE є обов'язковою вимогою для медичних пристроїв, призначених для Європейського Союзу.
Виробники медичного обладнання, зареєстровані за межами ЄС, повинні призначити уповноваженого представника - authorized representative, заснованого в одній з країн Європейського Союзу, для дій від його імені. Повноважний представник повинен бути зареєстрований в новій європейській базі даних по медичним пристроям EUDAMED.